Geliştirilen teknoloji ile laboratuvar ortamında deri hücrelerinden üç boyutlu insan beyin modelleri üretilerek, otizm ve epilepsiye yol açan beyin bozukluklarının kökenleri hakkında ipuçları bulundu.
Hastalardan alınan dokularla beyin modellerinin yapıldığı araştırma Cell Stem Cell dergisinde yayımlandı.
Bu araştırma otizm, şizofreni ve epilepsi gibi nöropsikiyatrik hastalıkların temelinde yatan biyolojik mekanizmaları öne çıkarabilir.
Otizm ve epilepsiye neden olan genetik bir bozukluk olan Timothy Sendromu (TS), kalp, el ve ayak parmakları ve sinir sistemi dahil vücudun birçok bölgesini etkileyen ender, genetik bir hastalık. Bu hastaların yaklaşık 85'inde otizm ve epilepsi görülüyor.
Bu sendrom üzerine yapılan çalışmalar, beyin gelişimini etkileyen birçok genetik hastalığın modellenmesinde faydalı bir strateji olacak.
Stanford Üniversitesi Psikiyatri ve Davranış Bilimleri Fakültesine bağlı Pasca Laboratuvarı'nda araştırmaya imza atan Dr. Fikri Birey, hastalardan alınan deri örneklerini önce kök hücrelerine, daha sonra da ön beyin kürelerine dönüştürdü.
Dr. Birey ve ekip arkadaşları, bu yolla geliştirilen beyin modellerini kullanarak, hastaların kişisel erken beyin gelişimlerindeki bazı kritik süreçleri mikroskop altına almayı başardılar.
"Hastaların kişisel ve belirli beyin bölgelerini üç boyutlu kültürler olarak oluşturuyoruz"
2012 yılında Nobel Ödülü'ne layık görülen çalışma, bir bireyden alınan deri hücrelerinin, kök hücrelere dönüştürülebildiği bir teknoloji kullanılarak yapıldı.
Bu araştırmada, iki beyin bölgesi hastaların deri-bazlı kök hücrelerinde ayrı ayrı üretildi.
Daha sonra gelişimleri sırasında spesifik bölgeler arası etkileşimlerini modelleme amacıyla bir araya getirildiler.
Bu modüler platformu ilk defa 2017 yılında geliştiren Dr. Birey, "İleride, birçok hastalıktan mustarip kişilerin, bireysel ve belirli beyin bölgelerini üç boyutlu kültürler olarak oluşturabileceğiz. Bu da beyin bölgelerinin kap içerisinde gelişimlerini izleyebilmek ve hastalığın daha önce bilinmeyen, kendine özgü özelliklerini keşfedebilmek imkanı sağlayacak. Bu çalışmalarla insan beyin modelleri aracılığıyla birçok beyin gelişimsel hastalığını zaman içinde doku, hücre ve molekül seviyelerinde kapsamlı şekilde anlayacağız. Bu sayede yeni tedavi yöntemleri geliştirebilmeyi hedefliyoruz" şeklinde bilgi verdi.
"Birçok gelişimsel ve psikiyatrik hastalığın odak noktası olan beynin ön bölgesinin gelişim modelini yaptık"
Bir süredir bu yöntemi kullanarak beyin hücreleri elde ettiklerini kaydeden Birey, "Kişisel kök hücre bazlı hastalık modelleme yaklaşımları yakın zamana kadar çoğunlukla iki boyutlu modeller oldu. İnsan beyin gelişiminin daha karmaşık yönlerinin benzerini kapta modelleyebilmek için, bu araştırmada üç boyutlu bir yaklaşım benimsedik, bu tür beyin benzeri kültürlere 'beyin organoid' kültürleri deniyor. 2017 yılında Nature dergisinde yayımlanan araştırmamızda, bu stratejiyi kullanarak, iki beyin bölgesinin gelişim sürecinin iletişimini modellemek adına 'assembloid' platformunu geliştirdik. Bu platformla, birçok gelişimsel ve psikiyatrik hastalığın odak noktası olan beynin ön bölgesinin gelişim modelini öncelikle geliştirmeyi tercih ettik. Bu assembloid modelinin bize sağladığı en önemli avantajlardan biri daha önce gözlemleyemediniz, ön beyin gelişiminde çok önemli olan nöron göçünü başından sonuna kadar takip edebilme olanağı sunması. Birçok psikiyatrik ve gelişimsel hastalığa yol açan mutasyonlar bu göç sürecini de yakından etkiliyor" diye konuştu.
Hedef: Kişiye özel beyin modelleri geliştirmek
CACNA1C geninin, bipolar bozukluklar, depresyon ve şizofrenide oluşan araştırmalarda sıkça rastlanan bir gen olduğunu belirten Birey, şunları anlattı:
İnsan beyninin erken gelişimi hakkında aslında çok az şey biliyoruz. Embriyo beyin dokusuna erişimin kısıtlı olmasından kaynaklanan bir durum bu. Otopsiler ve fonksiyonel MRI incelemeleri yararlı olmakla birlikte, bunlar genellikle hücresel düzeyde canlı insan beyninin işlevini anlamak için yeterli değil.
Otizm, şizofreni ve epilepsi gibi nöropsikiyatrik bozuklukların bu erken gelişim süreciyle olan ilişkisi büyük bir önem taşıyor. Bu sahadaki uzun süreli hedeflerden birisi de insan beyin modellerini kullanarak, bu tür bozuklukların temelinde yatan sorunlara ilişkin kişiye özel modeller geliştirmek ve daha önce erişimi mümkün olmayan hastalık mekanizmalarını tanımlamak.
Bunun bir örneği, bizim Timothy Sendromuna ve birçok daha psikiyatrik hastalıkta mutasyona uğradığı bilinen CACNA1C geninin fonksiyonunu baz aldığımız son 5 senedeki çalışmalar.
"Hücrede kalsiyumun birikmesi genleri etkiliyor"
Hastalığının moleküler yapısı hakkında Birey, şu bilgileri verdi:
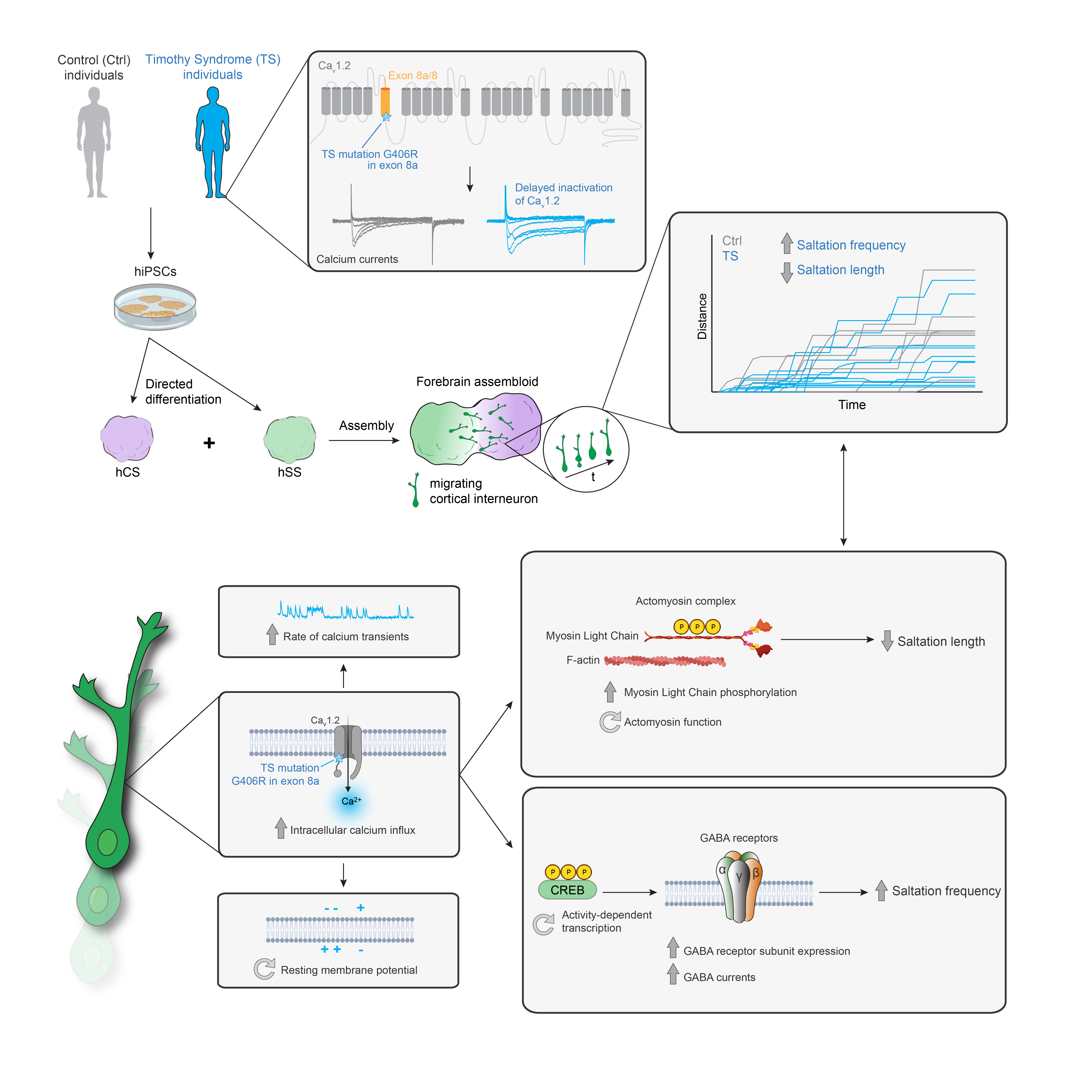
Bu hastalığa, kalsiyumu hücrelerin içine taşıyan kalsiyum kanalının oluşumunu düzenlemekten sorumlu bir gen olan CACNA1C'de meydana gelen mutasyonlar neden oluyor. Bu gen mutasyona uğradığı zaman, kanalın kapanması gecikiyor ve hücrelerin kalsiyum yüklemesine neden oluyor.
Hücre içinde olması gereken kalsiyum dengesinin bozulması hücre sağlığını ve görevlerini birçok açıdan olumsuz etkiliyor. Bu durumdan en çok kalp ve beyin etkileniyor. Ancak, bu sendromda görülen bu hücresel kalsiyum yüklenmesinin hastalarda bu organları nasıl etkilediğine dair az bilgiye sahibiz.
"Bu göç bozukluğu daha sonraki safhalarda ön beyin devrelerinde hiperaktiviteye neden oluyor"
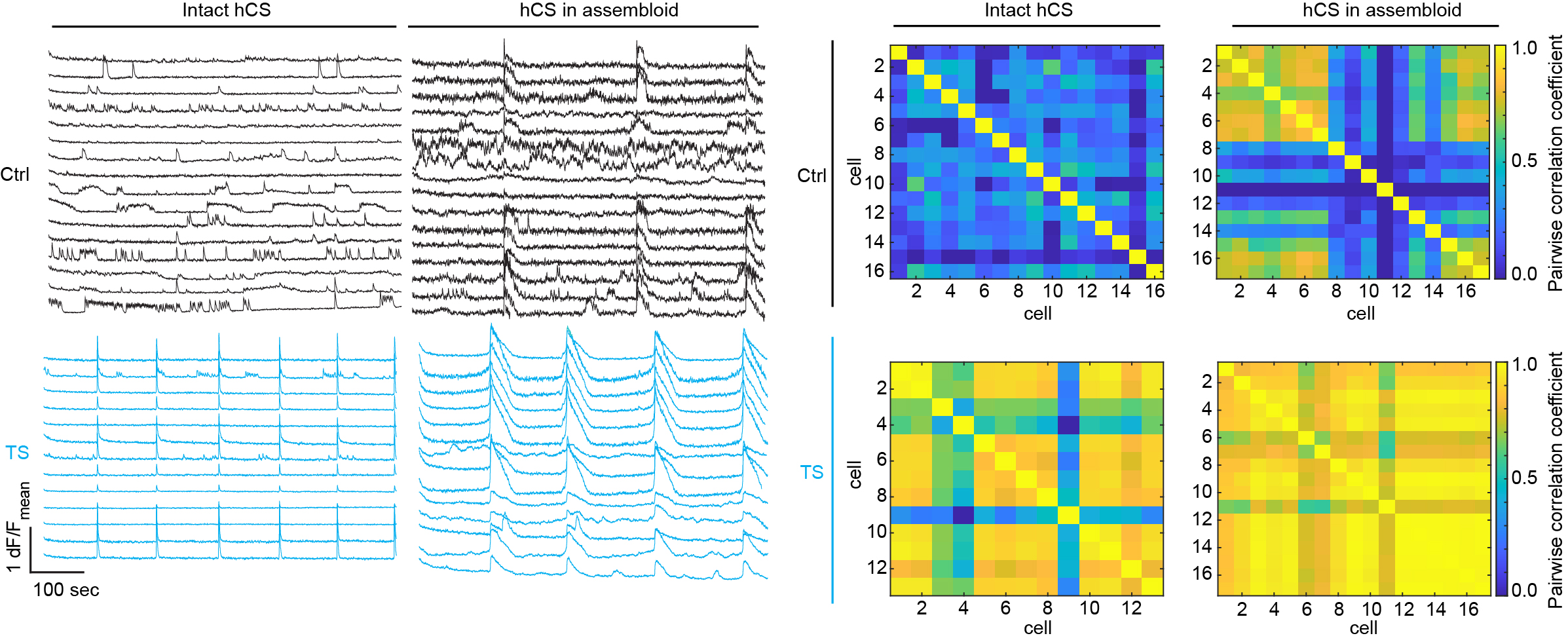
Timothy Sendromlu hastalardan alınan örneklerde, beynin ön bölümündeki hücrelerde göçün olağandışı olduğu gözlemlendi.
Bu durumda bu hastalarda hatalı olarak oluşabilecek ön beyin devrelerine işaret ediyordu.
Hücre göçünün önemli düzenleyicilerinden biri de hücre içi kalsiyum seviyesi.
Birey, şu bilgileri verdi:
Çalışmamızın önemli parçalarından biri de bu hastalardaki göç bozukluğunun hücre içi kalsiyum tarafından yönetilen 2 moleküler sinyalizasyon mekanizmasının bozukluğundan kaynaklandığını keşfetmekti. Bu sendromda bu iki mekanizmanın nasıl normal fonksiyonuna dönüşeceğini de çeşitli ilaçlar aracılığıyla gösterdik.
En sonunda bu göç bozukluğunun daha sonraki safhalarda ön beyin devrelerinde hiperaktiviteye neden olduğunu gözlemledik. Bu da bu hastalarda sıkça rastlanan epileptik beyin nöbetlerini andırıyor.
Özetle, bu çalışmamız daha önce Timothy Sendromlu hastalarda karakterize edilmemiş hastalık mekanizmaları öne sürüyor, bu mekanizmaların hangi ilaçlarla müdahale edilebileceğine dikkat çekiyor. Bu bozuk göç mekanizmalarının bu sendromun beyin devre gelişiminde hiperaktiviteye yol açan etkileşimler yarattığına işaret ediyor.
Gelecekteki hedeflerinden söz eden Birey, son olarak "Gün be gün daha çok geliştirdiğimiz assembloid ve benzeri kök hücre modellerini kullanarak gelişimsel birçok beyin hastalığının daha önce ulaşılamayan bir çok yönünü, su yüzüne çıkarmak. Daha efektif tedavi ve ön tanı olanakları geliştirmek ve bu aşamada insan beyin gelişiminin kendisini daha iyi anlamak" ifadelerini kullandı.
© The Independentturkish